CBSE Class 11 Chemistry Notes For Chapter 3 Valency
The valency of an element is defined as the combining capacity of that element. The valency of an element is usually expressed in terms of the number of H-atoms that combine with an atom of the element.
- The chemical properties of an element depend upon the number of electrons present in the outermost shell ofthe atom.
- Electrons present in the outermost shell are called valence electrons and these electrons determine the valency ofthe atom.
- In the case of the representative elements the valency of an atom is generally equal to either the number of valence electrons or equal to eight minus the number of valence electrons,
- However, transition and inner-transition elements exhibit variable valency involving electrons of the outermost shell as well as d- or f-electrons present in penultimate or antepenultimate shells.
Variation of valency in a period:
In the case of the representative elements, the number of valence electrons increases from 1 to 7 from left to right in a period.
- Oxygen-based valency increases from 1 to 7 and it becomes a zero noble gas series (because of its inertness).
- The maximum valency of ‘8’ is shown only by Os and Ru in OsO4 and RuO4 respectively. These two elements (transition elements) belong to a group- 8 (VmB)in the periodic table.
- However, hydrogen-based and chlorine-based valency of representative elements along a period first increases from group-1 to 4 (valency= group no.) and then decreases from group-4 to 0 (valency= 8- group no).
Valency of the elements of the third period concerning oxygen and hydrogen:

Valency of elements of the second period to chlorine:

Variation of valency in a group:
On moving down a group, the number of valence electrons remains the same. Therefore, all the element groups exhibit the same valency.
Valency Class 11 Notes NCERT
Example:
All the elements of group-IA (Li, Na, K, Rb etc.) have alency T’ and that of group-2A (Mg, Ca, Sr etc.) exhibit avalencyof’21Noble gases present in group-8A are zerovalent since these elements are chemically inert.
Ionisation Enthalpy or inonisation potential.
If energy is supplied to an atom, electrons may be promoted to higher energy states. If sufficient energy is supplied, one or more electrons may be removed completely from the atom leading to the formation of a cation. This energy is referred to as ionisation energy or orionisation enthalpy (ΔHi).
Ionisation Enthalpy or ionization potential Definition:
Ionisation enthalpy or more accurately first ionisation enthalpy of an element is defined as the amount of energy required to remove the most loosely bound electron from the valence shell of an isolated gaseous atom existing in its ground state to form a cation in the gaseous state.
Explanation:
If ΔH1(or I1) is the minimum amount of energy required to convert any gaseous atom in its ground state into gaseous ion M+, then the ionisation enthalpy or more accurately first ionisation enthalpy of M is ΔH1(or I1)

Importance:
- The ionisation enthalpy of an element gives an idea about the tendency of its atoms to form gaseous cations.
- Energy is always required to remove electrons from an atom and hence, ionisation enthalpies are always positive.
Units:
It is expressed in kj per mole of atoms (kj. mol-1).
Formerly, it was expressed in electron-volt per atom (eV- atom-1) or kcal per mole of atoms (kcal. mol-1)
1ev per atom =23.06 kcalmol-1=96.5 kl-mol¯¹.
Ionisation enthalpy :
‘Ionisation enthalpy is also called ‘ionisation potential’ because it is the minimum potential difference required in a discharge tube to remove the most loosely bound electron from an isolated gaseous atom to form a gaseous cation.
Successive ionisation enthalpies:
Like the removal of the first electron from an isolated gaseous atom, it is possible to second, third etc., electrons successively from cations one after another.
The minimum amount of energy required to remove the second, third etc., electrons from unipositive, dipositive etc., ions to form M2+, M3+ etc., ions of the element are called second ΔH2(or I3), tlirid ΔH3 (or I3 ) etc., ionisation enthalpies respectively.
⇒ \( \mathrm{M}^{+}(g)+\Delta H_2\left(\text { or } I_2\right) \rightarrow \mathrm{M}^{2+}(g)+e \)
⇒ \( \mathrm{M}^{2+}(g)+\Delta H_3\left(\text { or } I_3\right) \rightarrow \mathrm{M}^{3+}(g)+e\)
The second ionisation enthalpy is higher than the first ionisation enthalpy as it is more difficult to remove an electron from a cation than from a neutral atom. ] Similarly, the third ionisation enthalpy is higher than the second and so on i.e.,
ΔH1(or I1) < ΔH2(or l2) < ΔH3(or l3)
If not mentioned, the term ‘ionisation enthalpy is always used to mean the first ionisation enthalpy of an element.
Formerly, first, second, third etc, ionisation enthalpies were denoted by the symbols I1, I2, I3 etc. Such symbols will be used in many places in this book.
Factors governing ionisation enthalpy:
Atomicsize:
- Ionisation enthalpy decreases as the atomic size increases and vice-versa.
- The attractive force between the electron (to be removed) and the nucleus is inversely proportional to the distance between them.
- Thus, as the size of the atom increases, the hold of the nucleus over valence electrons decreases and consequently ionisation enthalpy decreases. For example, l1(Li)>l1(Na)>I1(K).
The magnitude of nuclear charge:
- Ionisation enthalpy increases with an increase in nuclear charge and vice-versa.
- This is due to the fact the force of attraction between the valence electron (to be removed) and the nucleus increases with an increase in the nuclear charge provided that the outermost electronic shell remains the same.
Screening effect of inner-shell electrons:
- As the screening effect or shielding effect of the inner electrons increases, the ionisation enthalpy decreases
- In multi-electron atoms, the inner electronic shells act like a screen between the nucleus and the outermost electronic shell.
- As a result, the nuclear attractive force acting on the electrons in the outermost shell is somewhat reduced i.e., the effective nuclear charge gets reduced to some extent.
- Thus, the inner-electronic shells shield the electron (to be removed) from the nuclear attractive force, resulting in a reduction of ionisation enthalpy.
If other factors do not change, the ionisation enthalpy decreases with an increase in the number of inner electrons.
- In multi-electron atoms, the ability of the electrons present in the inner shells to shield or screen the outer electrons from the attractive force of the nucleus is called the shielding effect or screening effect.
- Naturally, the magnitude of the screening effect depends on the number of electrons present in the inner shells.
- In a particular energy level, the screening effect of the electrons presenting different subshells follows the sequencers >p> d> f.
- Due to the screening effect, the valence shell electrons do not feel the full charge ofthe nucleus.
- The actual nuclear charge experienced by the valence shell electrons is called the effective nuclear charge.
- This is given by the relation, Effective nuclear charge (Z)= total nuclear charge (Z) – screening constant (cr) where the screening constant (cr) takes into account the screening effect ofthe electrons present in the inner shells.
Penetration effect of electronic subshells:
Ionisation enthalpy increases as the penetration effect ofthe electron (to be removed) increases. It is known that in the case of multielectron atoms, the electrons in the s -s-orbital have the maximum probability of being found near the nucleus. In a given quantum shell this probability goes on decreasing in the sequence s->p-> d-> f.
This means that in a given shell, the penetration power of different subshells decreases in the order: of s->p-> d-> f-
- Now, if the penetration power of an electronic is greater, it is closer to the nucleus and held more firmly by it.
- So it is more difficult to remove such an electron from the atom and consequently, ionisation enthalpy will be high.
- Thus for the same shell, the energy needed to knock out an s -s-electron is greater than that required for a p-electron, which in turn will be more than that required to remove a d-electron and so on. In other words, ionisation enthalpy follows the sequence, s>p> d> f.
Effect of half-filled and filled subshells:
- It is known that half-filled and filled subshells have extra stability associated with them.
- Therefore, the removal of electrons from such subshells (having extra stability) requires more energy than expected.
- Consequently, atoms having half-filled or filled subshells in their valence-shell have higher values of ionisation enthalpies.
Example:
Be(ls22s2) has higher ionisation enthalpy than B(ls22s22p1) because ionisation of Be requires the removal of one electron from its filled 2s -orbital in the valence shell.
For similar reasons Mg(ls22s22p63s2) has higher ionisation enthalpy than Al(ls22s22p63s23p1)
N(ls22s22p3) has higher ionisation enthalpy than O(ls22s22p4) because ionisation of nitrogen requires the removal of one electron from its half-filled 2p -the valence shell. Similarly, the ionisation enthalpy of P(3s23p3) is greater than that of S(3s23p4).
CBSE Class 11 Chemistry Valency Notes PDF
Effect of the electronic configuration of the outermost shell:
- Atoms, having the outermost electronic configuration ns2np6, are exceptionally stable because of their filled octet.
- Removal of an electron from an atom having such a stable electronic configuration requires a large amount of energy.
- Consequently, the noble gases He, Ne, Ar, Kr, Xe etc. (with outermost electronic configuration ns2np6) have very high ionisation enthalpy.
Variation of ionisation enthalpy in the periodic table:
- The periodic trends of the first ionisation energy of the elements are quite striking as seen from the graph.
- The graph consists of several maxima and minima. In each period maxima occur at the noble gases which have filled the octet with the electronic configurations (ns2np6).

- Due to very high ionisation enthalpies, these elements are almost inert and show extremely low chemical reactivity.
- In each period minima occur at the alkali metals which have only one electron in the outermost s -orbital. Due to very low ionisation enthalpies, these elements are highly reactive.
- Variation of ionisation enthalpy across a period: For representative elements (s and p -p-block elements), ionisation enthalpy usually increases with increasing atomic number across a period.
This is because as we move from left to right across a period—
The nuclear charge increases regularly, several shells remain the same and the addition of different electrons occurs in the same shell, and atomic size decreases.
- As a result of a gradual increase in nuclear charge and a simultaneous decrease in atomic size, the valence electrons are more and more tightly held by the nucleus.
- Therefore, more and more energy is needed to remove one valence electron and hence, ionisation enthalpy increases with an increase in atomic number across a period.
In any period, alkali metal has the lowest ionisation enthalpy and inert gas has the highest ionisation enthalpy.


On careful examination of ionisation enthalpy values, some irregularities in the general trend are noticed. Can each period be explained based on different factors governing ionisation enthalpy?
Examples:
1. I1 of Be>I1 of B:
- Forionisation of boron (1s22s22p1), one electron is to be removed from the singly filled 2p orbital
- And this requires lesser energy, while for the ionisation of beryllium (1s22s2) one electron is to be removed from the more penetrating For For For filled For 2s For orbital.
- Furthermore, the Removal of an electron from Batom gives B+ a stable electronic configuration with a filled 2s -subshell (ls22s2) and so it requires a smaller amount of energy.
- On the other hand removal of an electron from the filled 2s -orbital of Be -atom to give Be+ (1s22s1) requires a greater amount of energy.
- Consequently, the first ionisation enthalpy of B is less than that of Be. of
2. I1 of N > I1of O:
- The electronic configuration of nitrogen (ls22s22p3) in which the outermost 2p -subshell is exactly half-filled is more stable than the electronic configuration of oxygen (ls22s22p4)in which the 2psubshell is neither half-filled nor filled.
- Removal of 1 electron from the O -atom gives 0+ with a stable electronic configuration having a half-filled 2p -subshell (ls22s22p23), but this is not so in the case of the N -atom because N+ has the electronic configuration ls22s22p2.
- In other words, the removal of an electron from the O -atom gives a cation with a more stable electronic configuration than that obtained by the removal of one electron from the N -atom. Thus, the first ionisation enthalpy of oxygen is less than that of nitrogen.
⇒ \(\mathrm{N}\left(1 s^2 2 s^2 2 p^3\right) \stackrel{-e}{\longrightarrow} \mathrm{N}^{+}\left(1 s^2 2 s^2 2 p^2\right)\)
⇒ \(\mathrm{O}\left(1 s^2 2 s^2 2 p^4\right) \stackrel{-e}{\longrightarrow} \mathrm{O}^{+}\left(1 s^2 2 s^2 2 p^3\right)\)
3. The very high I1 value Ne:
The exceptionally high value of the first ionisation enthalpy of neon (noble gas) amongst the elements of the 2nd period is due to its stable electronic configuration(ns2np6) ofthe outermost shell.
Variation of ionisation enthalpy down a group:
For representative elements, ionisation enthalpy decreases regularly with an increase in atomic number on moving down a group from one element to the other.
NCERT Class 11 Chemistry Valency Solutions
Explanation: The regular decrease in ionisation enthalpy (1.E.) may be attributed to the following factors:
On moving down a group, the atomic size increases successively due to the addition of one new electronic shell at each succeeding element.
- Thus, the distance of valence shell electrons from the nucleus increases.
- Consequently, the nuclear attractive force on the valence electrons decreases and this, in turn, decreases the ionisation potential.
- There is an increase in the shielding effect on the outermost electrons due to an increase in the number of inner electronic shells. This increased shielding effect tends to decrease the ionisation potential on moving down a group.
- On moving down a group, the nuclear charge increases regularly and this increases the force of attraction of the nucleus on the valence electrons; this tends to increase the ionisation potential.
- The combined effect of the increase in size and the shielding effect outweighs the effect of the increased nuclear charge.
- Consequently, the ionisation enthalpies of the elements decrease regularly on going down a group.
This is evident from the values of the first ionisation enthalpies of the elements of group-1 (alkali metals) as given in the adjacent table.


Periodic variation of first ionisation enthalpies (eV) of the elements is evident from the following table.

Some important facts about ionisation enthalpy:
- The ionisation enthalpy of representative elements (s and block elements) increases from left to right across the period. Exceptions are observed for some pairs of elements,
- Example:
- I1 (Be)>I1 (B)
- I1 (Mg)>I1 (Al)
- I1 (N)>I1 (O)
- In any period, alkali metal has the least ionisation enthalpy. Cesium (Cs) has the lowest value of I. All the elements.
- In each period, inert gas elements show the highest value of first ionisation enthalpy. Helium (He) has the maximum value ofI.E. of all the elements.
- Among the representative elements, metals have low I.E., while non-metals have high values of I.E.
- Generally, first ionisation enthalpies of transition elements (d -block elements) increase slowly from left to right in a period. This is partly due to the poor screening effect of d orbitals and partly due to electron-electron repulsive forces.
- f-block elements also show a small change in their ionisation enthalpies on increasing atomic number.
- . From Pd to Ag, from Cd to In and also from Hg to Tl, there is a sudden decrease in ionisation enthalpy even though the atomic number increases.
Pair of elements

Electron-gain enthalpy or electron affinity:
Energy is released when an electron is added to an isolated gaseous atom to convert it into a negative ion.
This energy is called electron-gain enthalpy. Electron-gain enthalpy of an atom is thus a measure of its tendency to form an anion. ΔHegor EA denotes it.
Electron-gain enthalpy or electron affinity Definition:
Electron-gain enthalpy is defined as the enthalpy change involved when an electron is added to an isolated gaseous atom in its lowest energy state (ground state) to form a gaseous ion carrying a unit negative charge.

Explanation:
If q is the amount of energy released when an electron is added to the isolated gaseous atom ‘X’ in its ground state to convert to the gaseous ion X-, then the electron-gain enthalpy (electron affinity) of X is given by, ΔHeg= -q
⇒ \(\mathrm{F}(g)+e\longrightarrow \mathrm{F}^{-}(g)+328 \mathrm{~kJ} \cdot \mathrm{mol}^{-1} \)
Or, \(\mathrm{F}(g)+e\longrightarrow \mathrm{F}^{-}(g), \Delta H=-328 \mathrm{~kJ} \cdot \mathrm{mol}^{-1} \)
⇒ \(\mathrm{Be}(g)+e\longrightarrow \mathrm{Be}^{-}(g)-66 \mathrm{~kJ} \cdot \mathrm{mol}^{-1}\)
Or, \(\mathrm{Be}(g)+e\longrightarrow \mathrm{Be}^{-}(g), \Delta H=66 \mathrm{~kJ} \cdot \mathrm{mol}^{-1}\)
When an F -atom combines with an electron to form an F- ion, energy is released. So enthalpy change has a negative value. Thus electron-gain enthalpy of fluorine is given by AHeg = be supplied to convert a Be -atom to a Be ion.
So enthalpy change has a positive value. Thus electron-gain enthalpy of beryllium is given, by ΔHeg= +66 kj. mol-1
Class 11 Chemistry Valency Definition and Examples
Points to remember:
- Electron-gain enthalpy of an atom is a measure of its tendency to form an anion.
- Electron-gain enthalpy has usually a negative value, but it may also have a positive value, especially for noble gases.
- The numerical value of the ionisation enthalpy of an I negative ion (X-) is equal to the electron-gain enthalpy of the neutral atom (X).
However, energy is usually evolved during the process of electron acceptance but energy is usually absorbed during the expulsion of electrons from an atom. So electron gain enthalpy of X and ionisation enthalpy of X- have opposite signs.
- Electron-gain enthalpy with a -ve sign indicates that energy is released when the neutral atom accepts an electron (only numerical values are taken for comparison when periodicity or other properties are considered).
- The high value of electron-gain enthalpy indicates that an added electron is strongly bound, while a low value indicates that a new electron is weakly bound to the atom.
Units:
Electron-gain enthalpies are expressed in kilojoule per mole (kj. mol--1) or in electronvolt (eV) per atom.
Successive electron-gain enthalpies:
Like the second and higher ionisation enthalpies, second and higher electron-gain enthalpies are also possible. However, the addition of a second electron to a negative ion (X–) is opposed by the electrostatic force of repulsion.
So energy is to be supplied for the addition ofthe second electron. Thus, the second electron-gain enthalpy of an element is positive, and so is the third, and so on.
For example, when an electron is added to an oxygen atom to form an O-ion, energy is released. However, when another electron is added to the O– ion to form the O2- ion, energy is absorbed.
First electron-gain enthalpy:
⇒ \(\begin{array}{r}
\mathrm{O}(g)+e \longrightarrow \mathrm{O}^{-}(g), \quad \Delta H_{e g}=-141 \mathrm{~kJ} \cdot \mathrm{mol}^{-1} \\
\text { Energy released }
\end{array}\)
Second electron-gain enthalpy:
⇒ \(\begin{array}{r}
\mathrm{O}^{-}(\mathrm{g})+e \longrightarrow \mathrm{O}^{2-}(\mathrm{g}), \quad \Delta H_{e g}=\underset{ }{780 \mathrm{~kJ} \cdot \mathrm{mol}^{-1}} \\
\text { Energy absorbed }
\end{array}\)
Similarly, the first and second electron-gain enthalpies of sulphur are -200 kj mol-1 and +590 kj mol-1 respectively.
Factors governing electron-gain enthalpy:
In general, the factors favouring the ionisation process disfavour the electron-gain process.
Effective nuclear charge:
As effective nuclear charge (Z+) increases, the force of attraction between the nucleus and the incoming electron increases and hence, the numerical value of electron gain enthalpy increases.
Thus, the numerical magnitude ofelectrongain enthalpyof carbon (Z = 6, IE = -122 kj.mol-1 ) is greater than that ofboron(Z = 5, IE = -27 kj-mol-1 ).
Atomic size:
As the size of the atom increases, the distance between the nucleus and the outermost shell (which receives the incoming electron) increases.
- If the effective nuclear charge (Z+) per electron at the periphery is more or less the same for different species
- Example: In a group of representative elements), the force of attraction towards the nucleus of the electrons at the periphery is less for the larger species.
- Consequently, the numerical magnitude of electron-gain enthalpy decreases as the atomic size increases. Thus for representative elements, the numerical value of electron-gain enthalpy decreases as the atomic number increases on moving down a group.
Nature of the orbital into which new electron gets accommodation:
- Orbitals which can penetrate more towards the nucleus are more suitable to accommodate the incoming electron.
- Thus the ease of accommodation of Incoming eLectron follows the order ns> np> nd > nf, as the penetration effect of different orbitals follows this sequence.
- So the numerical magnitude of electron-gain enthalpy decreases in the sequence ns > np> nd> nf.
Nature of the outer electronic configuration:
If the atoms of an element bear extra stability due to either the half-filled or full-filled subshell in their outermost level, then such atoms are very much reluctant to accept the incoming electron.
- On the other hand, if the newly added electron creates a half-filled or full-filled subshell, then the process is favoured.
- Thus some ofthe elements of Gr 2A(ns2), Gr-2B[(n- 1)d10ns2], Group-VA (ns2np3) and all the noble gas elements (ns2np6) have positive electron-gain enthalpies (ΔHeg).
- On the other hand, elements of Gr-7A have very high electron-gain enthalpies with negative signs, because they can attain inert gas configuration accepting one electron.
- Variation of electron-gain enthalpy across a period: On moving from left to right in a period, effective nuclear charge, Z nuclear charge (Z)- shielding effect of the inner shells) increases and size decreases with the increase in atomic number.
- Both these factors tend to increase the nuclear attraction experienced by the incoming electron and hence, the numerical value of electron-gain enthalpy.
In general, increases in a period from left to right. It reaches a maximum value at Gr-7A (halogens).

Due to some characteristic electronic configuration, the general trend is violated in some cases.
For example: Be and N in the 2nd period; Mg and P in the third period).
Variation of electron-gain enthalpy down a group:
For the representative elements, on moving down a group, the effective nuclear charge Z per electron at the periphery (outermost shell) remains more or less constant because the effect of increased nuclear charge is counterbalanced by the shielding effect of the inner electronic shells.
- However, the atomic size gradually increases due to the addition of new quantum levels.
- Thus the nuclear attractive force experienced by any added electron (incoming electron) decreases as the atomic number increases, and consequently, the numerical value of electron-gain enthalpy decreases down a group.

Some typical trends in electron-gain enthalpy & their explanation:
Though the electrostatic attractive pull towards the nucleus favours the addition of an electron to the smaller-sized F -atom, the added electron, however, creates an unfavourable effect.

- The added electron Experiences significant electron-electron repulsion from the other electrons present in the small-sized 2p -subshell.
- On the other hand, in a chlorine atom, the added electron goes to the large-sized 3p -subshell. Hence, it experiences less electron-electron repulsion.
- Another factor that favours the uptake of electrons by the Cl -atom, is that there is the possibility of the delocalisation of the increased electron density in the vacant 3d -orbital of Cl-atom.
- This mechanism is not operative in F-atom because of the absence of d -orbital in the second shell. Consequently, the numerical value of electron-gain enthalpy of Cl is greater than that of F.
Electron-gain enthalpy is greater than that of O:
The reason for this anomaly is similar to that of Cl versus F.
- The added electron experiences considerable electron-electron repulsion from the other electrons present in the small-sized 2p -subshell of O.
- This repulsion outweighs the increased attractive force of the nucleus acting on the added electron. In the S-atom, the added electron goes to the large-sized 3p -subshell.
- Hence, it experiences less electron-electron repulsion. Another factor that favours the uptake of electrons by S -S-atoms is that there is a possibility ofthe delocalisation of the increased electron density in the vacant-3d -orbital of S-atom.
- This mechanism is not operative in the O -atom because of the absence of any d orbital in the 2nd shell.
- Consequently, the numerical value of electron-gain enthalpy S is greater than that of O.
Gr-2A metals (Example: Be, Mg etc.) have lower electron-gain enthalpies than Gr-IA metals (Example: Li, Na, K etc:
Gr- A metals have outer electronic configuration ns2. Hence, the addition of an extra electron brings the configuration ns2np1.
This process is disfavoured in two ways:
- The addition of a new electron destroys the full-filled subshell structure and accommodation of the new electron occurs in the p -orbital which is less penetrating. For alkali metals (ns¹), however,
- Accommodation of the new electron occurs in the ns -subshell giving rise to a filled ns² configuration.
Thus, the electron-gaining process is more favourable for Gr-1 A elements compared to Gr-2A elements. Be and Mg of Gr-2A have positive electron-gain enthalpy.
Valency Chapter 3 NCERT Class 11 Important Topics
Halogens have the highest electron-gain enthalpies:
- This is because of the valence-shell electronic configuration of the halogensis ns2np5 and so they require only one more electron to acquire the stable inert gas-like electronic configuration (ns2np6).
- As a result, halogen atoms have a strong tendency to accept an additional electron. Consequently, the numerical values of their electron-gain enthalpies are very high.
Phosphorous (3s23p3) has relatively low electron-gain enthalpy:
- This is because the P -atom has a relatively stable outer electronic configuration with exactly half-filled p -orbital.
- Hence, it is reluctant to accept an extra electron. Consequently, it has low electron-gain enthalpy.
The electron-gain enthalpy of noble gas is high and positive:
- The atoms of noble gases have a very stable outermost electronic configuration with filled subshells (ns2np6).
- Any additional electron would have to be placed in an orbital ofthe next higher energy level.
- The shielding effect of the inner electrons and the large distance from the nucleus makes the addition of an electron highly unfavourable. So, noble. High and acquisitive values electron-gain enthalpy.
Electronegativity
This topic will be discussed elaborately in the chapter ‘Chemical Bonding’ Here we will briefly discuss only the definition of electronegativity and its periodicity.
Electronegativity Definition:
Electronegativity is defined as the tendency of an atom to attract the shared pair of electrons towards its nucleus when the atom isovalently bonded in a molecule.
- Consequently, the more electronegative atom withdraws the bonding electron cloud more towards its nucleus giving rise to an accumulation of negative charge on it.
- The electronegativity of an element is not its inherent property. It depends on its surrounding environment in the molecule in which the electronegativity of the element is being considered.
- Thus the electronegativity of S is different in different compounds such as H2S, SO2, SF6 etc.
- Further, it is to be noted that unlike ionisation enthalpy and electron-gain enthalpy, electronegativity is not a measurable quantity.
Factors controlling electronegativity: Electronegativity of the elements depend on—
- The atomic number of an element, i.e., the total quantity of positive charge in the nucleus of an atom,
- Size of atom Or Atomicradius, number of electronicshes in an atom, oxidation state ofthe atom, state of hybridisation of the atom in the molecule under consideration.
- Note the electronegativity of elements.
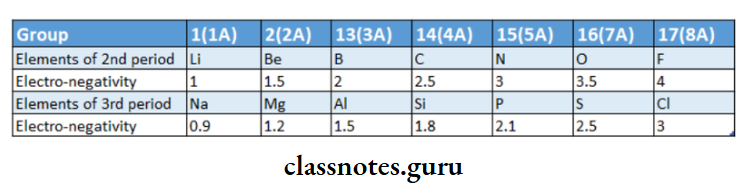
Variation of electronegativity across a period:
- As Cs 0.7 At 2.2 Ford -block element, on moving down from 3d- to from left to right along a period, nuclear charge Increases while the atomic radius or size decreases.
- Hence the attraction between the outer (or valence) electrons and the nucleus increases with increasing atomic number.
- Consequently, the electronegativity of the atom increases from left to right across a period.
- Thus alkali metals of group-1 on the extreme left have the lowest electronegativity whereas, the halogens in group-17 on the right have the highest values of electronegativity in their respective periods.
This is evident from the electronegativity values ofthe elements of the second and third periods.
Variation of electronegativity down a group:
As we move down a group, atomic size (radius) as well as the magnitude of nuclear charge increases but the effect of increased nuclear charge on the outer electrons is mostly counterbalanced by the screening effect of a larger number of inner electronic shells.
- Hence the nuclear pull on the outer (valence) electrons decreases due to the increase of atomic size on moving down a group.
- Consequently, the electronegativity of an atom decreases from top to bottom in a group.
- This is evident from the electronegativity values of the alkali metals of group-1 (IA) and halogen elements of group-17(8A)
Electronegativity values down a group:
Group – 1 Elements:

Group – 17 Elements:

Ford -block element, on moving down from 3d- to 4d -series, electronegativity falls slightly but on reaching 5d series, electronegativity increases due to lanthanide contraction.
Relationship between electronegativity and non-metallic (or metallic) character of elements:
Non-metallic elements have a strong tendency to gain electrons. So, electronegativity is directly related to the metallic character elements.
- It can be further extended to say that electronegativity is inversely related to the metallic character of elements.
- Thus the increase in electronegativity along a period is accompanied by an increase in non-metallic character (or decrease in metallic character) of elements.
- Likewise, the decrease in electronegativity down a group is accompanied by a decrease in the non-metallic character (or increase in metallic character) of elements.
All these periodic trends are summarised in the given figure:
Direction arrows indicate an increasing trend of the respective properties


Periodicity in density, melting point and boiling point
Different elements exhibit periodicity in various physical properties such as density, melting point, boiling point etc.
Periodic variation of density:
On moving along a period from left to right, the density of representative elements first increases reaches the maximum value at group-3A or 4A and then decreases with an increase in atomic number.
This trend is observed particularly in the case of representative elements. In a group, density generally increases from top to bottom with a rise in atomic number.

Periodic variation of melting and boiling points:
On moving along a period from left to right, the melting and boiling points of representative elements first increase, reach maximum values at group 4A and thereafter go on decreasing.
Minimum melting and boiling points are shown by the noble gas in the respective period.

Periodicity In Properties Of Oxides And Hydrides
Nature of oxides of the elements:
On moving from left to right across a period, the basic properties and electrovalent character of oxides of elements decrease while their acidic property and covalent character gradually increase.
- On the other hand, in a group, the basic property of oxides increases from top to bottom.
- The nature of the oxides of transition metals depends on the oxidation state of the metals.
- With the increase in the oxidation state of transition metals, the acidic properties of their oxides increase.
Basic and acidic nature of oxides of different elements:

Example:
CrO is a basic oxide, Cr2O3 is amphoteric and CrO3 is an acidic oxide. In the case of oxides of the elements of the second period, it is observed that lithium oxide (Li2O) is strongly basic. It reacts with water to produce a strong base namely lithium hydroxide (LiOH)
⇒ \(\mathrm{Li}_2 \mathrm{O}+\mathrm{H}_2 \mathrm{O} \rightleftharpoons 2 \mathrm{Li}^{+}+2 \mathrm{OH}^{-} \rightleftharpoons 2 \mathrm{LiOH}\)
BeO is an amphoteric oxide. It reacts with both acids and bases to form salt and water.
⇒ \(\text { Basic property: } \mathrm{BeO}+2 \mathrm{HCl} \rightarrow \mathrm{BeCl}_2+\mathrm{H}_2 \mathrm{O}\)
⇒ \(\text { Acidic property: } \mathrm{BeO}+2 \mathrm{NaOH} \rightarrow \mathrm{Na}_2 \mathrm{BeO}_2+\mathrm{H}_2 \mathrm{O}\)
B2O3 is an acidic oxide though it possesses a slight basic property. It reacts with water to form orthoboric acid and with alkali to yield borate salt.
CO2 is an acidic oxide and it reacts with alkali to produce carbonate salt. N2O is an acidic oxide. It reacts with alkali to produce salt and water.
⇒ \(\mathrm{B}_2 \mathrm{O}_3+3 \mathrm{H}_2 \mathrm{O} \rightarrow 2 \mathrm{H}_3 \mathrm{BO}_3 ; \mathrm{CO}_2+2 \mathrm{NaOH} \rightarrow \mathrm{Na}_2 \mathrm{CO}_3+\mathrm{H}_2 \mathrm{O}\)
⇒ \(\mathrm{N}_2 \mathrm{O}_5+2 \mathrm{NaOH} \rightarrow 2 \mathrm{NaNO}_3+\mathrm{H}_2 \mathrm{O}\)
Class 11 Chemistry Chapter 3 Valency Notes
Nature of hydrides of elements:
As we move from left to right across a particular period, the tendency of the elements to form hydrides and the thermal stability, covalent character, acidic property, and volatility of the hydrides increases while the reducing property progressively decreases.
- The hydrides of the strongly electropositive metals towards the left of a period are ionic having high melting points.
- On ionisation, they produce hydride ions (H-). Again, hydrides of non-metals towards the right of the period are covalent and have low melting and boiling points.
- On moving down a group, the tendency of the elements to form hydrides decreases.
- The stability of the hydrides also decreases in the same sequence. Variation of other properties along any group depends on the group to which the hydride-forming element belongs.
Hydrides of elements and variation in their properties:

Hydrides of alkali metals in group 1A and alkaline earth metals in group 2 are salt-like polar or ionic.
- These compounds comprise positive metallic ions and negative hydride ions (H¯). On electrolysis of these ions and negative hydride ions (H-).
- On electrolysis these are discharged at the cathode and anions (H- ions) at the anode;
Example:
Electrolysis of molten sodium hydride leads to the formation of metallic sodium at the cathode and H2 gas at the anode.

Hydrides of the elements of groups 4A to 7A are covalent and nonpolar;
Example:
CH4, SiH4, PH3 etc., are gaseous and insoluble in water. NH3 and H2S are gaseous but soluble in water. An aqueous solution of NH3 is feebly basic and the aqueous solution of H2S is weakly acidic.
On the other hand, HCl, HBr and HI dissociate almost completely despite being covalent compounds more soluble in water and dilute aqueous solutions.
⇒ \(\mathrm{HX}+\mathrm{H}_2 \mathrm{O} \rightleftharpoons \mathrm{H}_3 \mathrm{O}^{+}+\mathrm{X}^{-} \quad[\text { where } \mathrm{X}=\mathrm{Cl}, \mathrm{Br}, \mathrm{I}]\)
Aqueous solution of HX is strongly acidic. In electrolysis of their aqueous solutions hydrogen ions (H+) are liberated at the cathode and halide ions (X-) at the anode.
Example:
When an aqueous solution of hydrochloric acid is electrolysed, H2 gas is evolved at the cathode and Cl2 gas at the anode.


The trend of variation in properties of different elements in the periodic table from left to right across a period and from top to bottom in a group is shown in the given table-

NCERT Solutions Class 11 Chemistry Chapter 3 Valency
Diagonal Relationship Definition:
Some elements of certain groups in the second period show similarity in properties with the diagonally opposite elements of the third period, and such similarity in properties is referred to as a diagonal relationship.

Reason for diagonal relationship:
The Reason for the diagonal relationship is due to opposing trends in periodic properties along a period from left to right and down the group.
- For example, the atomic and ionic radius of elements decrease a periodic but increase down a group Ionisation enthalpy, electron gain enthalpy and electron negativity increase along a period but decrease down a group.
- On moving diagonally, two opposite trends mutually cancel, so the elements of the period- 2 and 3 listed above are related to each other diagonally and they show similar chemical properties. Thus Li resembles Mg; Be resembles Al; and B resembles Si.
- The diagonal relationship is also explained based on polarising power ofcation. On moving along the period from left to right, the charge on the cation increases, while ionic size decreases and hence polarising power increases.
- Again on moving down a group, the charge on the cation remains the same, while ionic size increases.
- Hence polarising power decreases. So on moving diagonally, polarising power remains more or less the same and the elements exhibit similar properties.
Absence of diagonal relationship in case of long periods:
- Because of the intervening d – and f-series, the diagonal relationship does not hold well for long-period elements (4th, 5th… period elements).
- Because the group trend of many properties in the transition series is opposite compared to that in the representative elements. However, the trend along the periods remains the same for both the representative and d -d-block elements.